- Autors Jason Gerald [email protected].
- Public 2024-02-01 14:14.
- Pēdējoreiz modificēts 2025-01-23 12:27.
Vai esat kādreiz atstājuši ūdens pudeli karstā saulē uz dažām stundām un atverot dzirdējuši vieglu "šņukstošu" skaņu? Tas ir saistīts ar principu, ko sauc par tvaika spiedienu. Ķīmijā tvaika spiediens ir spiediens, ko rada slēgta konteinera sienas, kad tajā esošā ķīmiskā viela iztvaiko (pārvēršas gāzē). Lai noteiktu tvaika spiedienu noteiktā temperatūrā, izmantojiet Clausius-Clapeyron vienādojumu: ln (P1/P2) = (ΔHtvaiks/R) ((1/T2) - (1/T1)).
Solis
1. metode no 3: izmantojot Clausius-Clapeyron vienādojumu
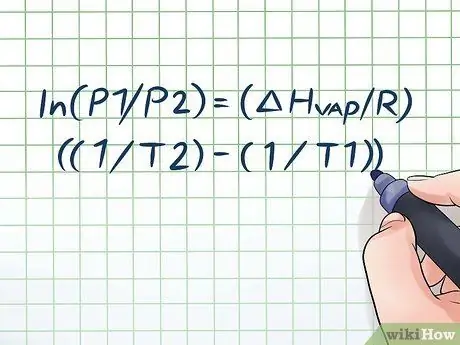
1. solis. Pierakstiet Clausius-Clapeyron vienādojumu
Formulu, ko izmanto, lai aprēķinātu tvaika spiedienu ar tvaika spiediena izmaiņām laika gaitā, sauc par Clausius -Clapeyron vienādojumu (nosaukts fiziķu Rūdolfa Klauzija un Benoita Pola jūdzes Kleipirona vārdā.) Būtībā šī ir formula, kas jums būs nepieciešama, lai atrisinātu lielāko daļu problēmu Tvaika spiediena jautājumi bieži sastopami fizikas un ķīmijas stundās. Formula ir šāda: ln (P1/P2) = (ΔHtvaiks/R) ((1/T2) - (1/T1)). Šajā formulā mainīgie norāda:
-
Htvaiks:
Šķidruma iztvaikošanas entalpija. Šo entalpiju parasti var atrast tabulā ķīmijas mācību grāmatas aizmugurē.
-
R:
Reālā/universālā gāzes konstante jeb 8,314 J/(K × Mol).
-
1. jautājums:
Temperatūra, pie kuras ir zināms tvaika spiediens (vai sākotnējā temperatūra).
-
T2:
Temperatūra, pie kuras tvaika spiediens nav zināms/vēlējās atrast (vai galīgā temperatūra).
-
P1 un P2:
Tvaika spiediens attiecīgi T1 un T2 temperatūrā.

2. solis. Ievadiet zināmos mainīgos
Clausius-Clapeyron vienādojums izskatās sarežģīts, jo tam ir daudz dažādu mainīgo, taču patiesībā tas nav tik grūti, ja jums ir pareiza informācija. Lielākajā daļā tvaika spiediena pamata problēmu ir uzskaitītas divas temperatūras vērtības un viena spiediena vērtība, vai divas spiediena vērtības un viena temperatūras vērtība - kad jūs to sapratīsit, šī vienādojuma atrisināšana ir ļoti vienkārša.
- Piemēram, teiksim, ka mums saka, ka mums ir 295 K tvertne ar šķidrumu, kuras tvaika spiediens ir 1 atmosfēra (atm). Mūsu jautājums ir šāds: kāds ir tvaika spiediens pie 393 K? Mums ir divas temperatūras vērtības un viena spiediena vērtība, tāpēc pārējās spiediena vērtības mēs varam atrast, izmantojot Clausius-Clapeyron vienādojumu. Pievienojot mūsu mainīgos, mēs iegūstam ln (1/P2) = (ΔHtvaiks/R) ((1/393) - (1/295)).
- Ņemiet vērā, ka Clausius-Clapeyron vienādojumam vienmēr jāizmanto temperatūras vērtība Kelvins. Jūs varat izmantot jebkuru spiediena vērtību, ja vien P1 un P2 vērtības ir vienādas.

3. solis. Ievadiet savas konstantes
Clausius-Clapeyron vienādojumam ir divas konstantes: R un Htvaiks. R vienmēr ir vienāds ar 8,314 J/(K × Mol). Tomēr H.tvaiks (iztvaikošanas entalpija) ir atkarīga no vielas, kuras tvaika spiedienu meklējat. Kā minēts iepriekš, jūs parasti varat atrast H vērtībastvaiks dažādām vielām ķīmijas vai fizikas mācību grāmatas aizmugurē vai tiešsaistē (kā, piemēram, šeit.)
-
Mūsu piemērā pieņemsim, ka mūsu šķidrums ir tīrs ūdens.
Ja aplūkojam tabulā H vērtībastvaiks, mēs atklājam, ka H.tvaiks tīrs ūdens ir aptuveni 40,65 KJ/mol. Tā kā mūsu H vērtība ir džoulos, nevis kilodžoulos, mēs varam to pārvērst par 40 650 J/mol.
- Pievienojot mūsu konstantes, mēs iegūstam ln (1/P2) = (40 650/8, 314) ((1/393) - (1/295)).
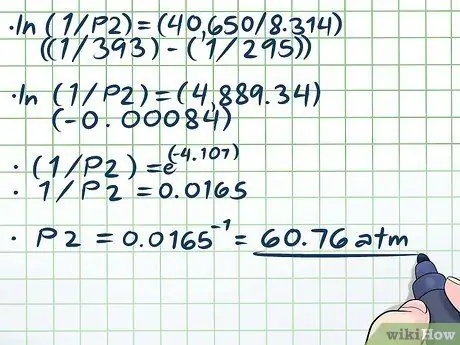
Solis 4. Atrisiniet vienādojumu
Kad vienādojumā esat iekļāvis visus mainīgos, izņemot meklēto, pārejiet pie vienādojuma risināšanas saskaņā ar parastās algebras noteikumiem.
-
Vienīgā sarežģītā mūsu vienādojuma atrisināšanas daļa (ln (1/P2) = (40 650/8, 314) ((1/393) - (1/295))) atrisina dabisko žurnālu (ln). Lai noņemtu dabisko žurnālu, vienkārši izmantojiet abas vienādojuma puses kā matemātiskās konstantes eksponentus. Citiem vārdiem sakot, ln (x) = 2 → eln (x) = e2 → x = e2.
- Tagad atrisināsim mūsu vienādojumu:
- ln (1/P2) = (40 650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0,0165
-
P2 = 0,0165-1 = 60, 76 atm.
Tam ir jēga - slēgtā traukā, paaugstinot temperatūru līdz gandrīz 100 grādiem (līdz gandrīz 20 grādiem virs viršanas temperatūras), radīsies daudz tvaika, strauji palielinot spiedienu.
2. metode no 3: Tvaika spiediena noteikšana ar izšķīdušo šķīdumu
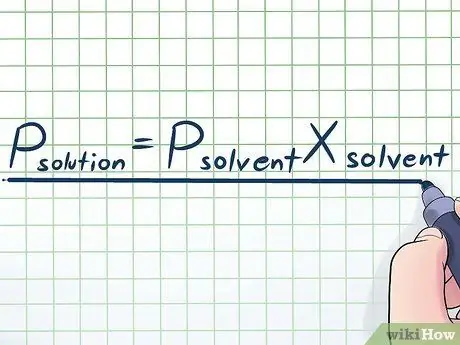
1. solis. Pierakstiet Raoult likumu
Reālajā dzīvē mēs reti strādājam ar tīru šķidrumu - parasti mēs strādājam ar šķidrumu, kas ir vairāku dažādu vielu maisījums. Daži no visbiežāk izmantotajiem maisījumiem tiek pagatavoti, izšķīdinot nelielu daudzumu noteiktas ķīmiskas vielas, ko sauc par izšķīdušo vielu daudzās ķimikālijās, ko sauc par šķīdinātāju. Šādos gadījumos ir lietderīgi zināt vienādojumu, ko sauc par Rula likumu (nosaukts fiziķa Fransuā-Māra Raula vārdā), kas uzrakstīts šādi: Lppšķīstošs= P.šķīdinātājsXšķīdinātājs. Šajā formulā mainīgie ir;
-
Lppšķīstošs:
Visa šķīduma tvaika spiediens (visi elementi kopā)
-
Lppšķīdinātājs:
Šķīdinātāja tvaika spiediens
-
Xšķīdinātājs:
Šķīdinātāja molu daļa
- Neuztraucieties, ja nezināt tādus terminus kā molu frakcija - mēs tos izskaidrosim nākamajās darbībās.

2. solis. Nosakiet šķīdinātāju un izšķīdiniet šķīdumā
Pirms aprēķināt jaukta šķidruma tvaika spiedienu, jums jāidentificē izmantotās vielas. Atgādinām, ka šķīdums veidojas, kad izšķīdušā viela izšķīst šķīdinātājā - ķīmisko vielu, kas izšķīst, vienmēr sauc par izšķīdušo vielu, un ķīmisko vielu, kas liek tai izšķīst, vienmēr sauc par šķīdinātāju.
- Strādāsim, izmantojot vienkāršos piemērus šajā sadaļā, lai ilustrētu mūsu apspriestos jēdzienus. Piemēram, mēs vēlamies atrast cukura sīrupa tvaika spiedienu. Tradicionāli cukura sīrups ir ūdenī šķīstošs cukurs (attiecība 1: 1), tāpēc mēs to varam teikt cukurs ir mūsu šķīstošā viela, un ūdens ir mūsu šķīdinātājs.
- Ņemiet vērā, ka saharozes (galda cukura) ķīmiskā formula ir C12H22O11. Šī ķīmiskā formula būs ļoti svarīga.
3. solis. Atrodiet šķīduma temperatūru
Kā redzējām iepriekš Clausius Clapeyron sadaļā, šķidruma temperatūra ietekmēs tā tvaika spiedienu. Parasti, jo augstāka temperatūra, jo lielāks tvaika spiediens - paaugstinoties temperatūrai, vairāk šķidruma iztvaiko un veido tvaikus, palielinot spiedienu traukā.
Mūsu piemērā pieņemsim, ka cukura sīrupa temperatūra šajā brīdī ir 298 K. (apmēram 25 C).
4. solis. Atrodiet šķīdinātāja tvaika spiedienu
Ķīmiskajiem standartmateriāliem parasti ir daudzu parasti lietotu vielu un savienojumu tvaika spiediena vērtības, taču šīs spiediena vērtības parasti ir derīgas tikai tad, ja vielas temperatūra ir 25 C/298 K vai tās viršanas temperatūra. Ja jūsu šķīdumam ir viena no šīm temperatūrām, varat izmantot atsauces vērtību, bet, ja nē, jums jāatrod tvaika spiediens šajā temperatūrā.
- Clausius -Clapeyron var palīdzēt - izmantojiet standarta tvaika spiedienu un 298 K (25 C) attiecīgi P1 un T1.
- Mūsu piemērā mūsu maisījuma temperatūra ir 25 C, tāpēc mēs varam viegli izmantot mūsu vienkāršo uzziņu tabulu. Mēs zinām, ka 25 ° C temperatūrā ūdens tvaika spiediens ir 23,8 mm HG

5. solis. Atrodiet šķīdinātāja molu daļu
Pēdējā lieta, kas mums jādara, pirms mēs to varam atrisināt, ir atrast mūsu šķīdinātāja molu daļu. Molu daļas atrašana ir vienkārša: vienkārši pārveidojiet savienojumus par molu, pēc tam atrodiet katra savienojuma procentuālo daļu no kopējā molu skaita. Citiem vārdiem sakot, katra savienojuma molu daļa ir vienāda ar (savienojuma moli)/(kopējais molu skaits vielā).
-
Pieņemsim, ka mūsu cukura sīrupa lietošanas recepte 1 litrs (L) ūdens un 1 litrs saharozes (cukura).
Šajā gadījumā mums jāatrod katra savienojuma molu skaits. Lai to izdarītu, mēs atradīsim katra savienojuma masu un pēc tam izmantosim vielas molmasu, lai to pārvērstu par molu.
- Masa (1 l ūdens): 1000 grami (g)
- Masa (1 l jēlcukura): aptuveni 1056, 8 g
- Moli (ūdens): 1000 grami × 1 mol/18,015 g = 55,51 mol
- Moli (saharoze): 1056, 7 grami × 1 mol/342,2965 g = 3,08 moli (ņemiet vērā, ka saharozes molmasu var atrast no tās ķīmiskās formulas, C12H22O11.)
- Kopējie moli: 55,51 + 3,08 = 58,59 mol
- Ūdens molu daļa: 55, 51/58, 59 = 0, 947
6. solis. Pabeigt
Visbeidzot, mums ir viss nepieciešamais, lai atrisinātu mūsu Raula likuma vienādojumu. Šī daļa ir ļoti vienkārša: vienkārši pievienojiet savas vērtības mainīgajiem lielumiem vienkāršotajā Raula likuma vienādojumā šīs sadaļas sākumā (Lppšķīstošs = P.šķīdinātājsXšķīdinātājs).
- Ievadot savas vērtības, mēs iegūstam:
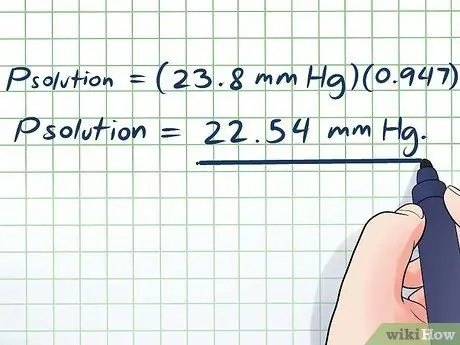
- Lpprisinājums = (23,8 mm Hg) (0, 947)
-
Lpprisinājums = 22,54 mm Hg.
Rezultātam ir jēga - molu izteiksmē daudz ūdens izšķīdina ļoti maz cukura (lai gan reālajā pasaulē abām sastāvdaļām ir vienāds tilpums), tāpēc tvaika spiediens tikai nedaudz samazināsies.
3. metode no 3: Tvaika spiediena noteikšana īpašos gadījumos

1. solis. Esiet piesardzīgs standarta temperatūras un spiediena apstākļos
Zinātnieki bieži izmanto temperatūras un spiediena vērtību kopu kā viegli lietojamu “standartu”. Šīs vērtības sauc par standarta temperatūru un spiedienu (vai STP). Tvaika spiediena problēmas bieži attiecas uz STP apstākļiem, tāpēc ir svarīgi atcerēties šīs vērtības. STP vērtības ir definētas šādi:
- Temperatūra: 273, 15 K. / 0 C / 32 F
- Spiediens: 760 mm Hg / 1 atm / 101, 325 kilopaskali

2. solis. Pārkārtojiet Clausius-Clapeyron vienādojumu, lai atrastu citus mainīgos
Pirmajā daļā sniegtajā piemērā mēs redzējām, ka Clausius -Clapeyron vienādojums ir ļoti noderīgs, lai atrastu tvaika spiedienu tīrām vielām. Tomēr ne visi jautājumi liks jums meklēt P1 vai P2 - daudzi lūgs jums atrast temperatūras vērtību vai dažreiz pat H vērtību.tvaiks. Par laimi, šajos gadījumos pareizas atbildes iegūšana ir vienkārši vienādojuma pārkārtošana, lai mainīgie, kurus vēlaties atrisināt, būtu vienādi vienādības zīmes pusē.
- Piemēram, pieņemsim, ka mums ir nezināms šķidrums ar tvaika spiedienu 25 torri pie 273 K un 150 torr pie 325 K, un mēs vēlamies atrast šī šķidruma iztvaikošanas entalpiju (ΔHtvaiks). Mēs to varam atrisināt šādi:
- ln (P1/P2) = (ΔHtvaiks/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHtvaiks/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Htvaiks Tagad mēs ievadām savas vērtības:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = Htvaiks
- 8, 314 J/(K × Mol) × 3033, 90 = Htvaiks = 25 223, 83 J/mol

Solis 3. Aprēķiniet izšķīdušās vielas tvaika spiedienu, kad viela rada tvaikus
Iepriekš minētajā Raoult likuma piemērā mūsu šķīdinātājs cukurs normālā temperatūrā pats par sevi neizdara spiedienu (padomājiet - kad pēdējo reizi augšējā skapī redzējāt iztvaikojošu cukura bļodu?) Tomēr, ja jūsu izšķīdušā viela iztvaiko, tas ietekmēs tvaika spiedienu. Mēs to ņemam vērā, izmantojot modificētu Rao likuma vienādojuma versiju: Lpprisinājums = (LppsavienojumsXsavienojums) Simbols sigma (Σ) nozīmē, ka, lai saņemtu atbildi, mums tikai jāsummē visi dažādu savienojumu tvaiku spiedieni.
- Piemēram, pieņemsim, ka mums ir risinājums, kas sastāv no divām ķīmiskām vielām: benzola un toluola. Kopējais šķīduma tilpums ir 12 mililitri (ml); 60 ml benzola un 60 ml toluola. Šķīduma temperatūra ir 25 ° C, un katras no šīm ķīmiskajām vielām tvaika spiediens 25 ° C temperatūrā ir 95,1 mm Hg attiecībā uz benzolu un 28,4 mm Hg attiecībā uz toluolu. Izmantojot šīs vērtības, atrodiet šķīduma tvaika spiedienu. Mēs varam to izdarīt šādi, izmantojot mūsu divu ķīmisko vielu standarta blīvuma, molmasas un tvaika spiediena vērtības:
- Masa (benzols): 60 ml = 0,060 l un reizes 876,50 kg/1000 l = 0,053 kg = 53 g
- Masa (toluols): 0,060 L un reizes 866, 90 kg/1000 L = 0,052 kg = 52 g
- Mols (benzols): 53 g × 1 mol/78, 11 g = 0,679 mol
- Moli (toluols): 52 g × 1 mol/92, 14 g = 0,564 mol
- Kopējie moli: 0,679 + 0,564 = 1,243
- Molu frakcija (benzols): 0,679/1, 243 = 0,546
- Molu daļa (toluols): 0,564/1, 243 = 0,454
- Risinājums: P.risinājums = P.benzolsXbenzols + P.toluolsXtoluols
- Lpprisinājums = (95,1 mm Hg) (0, 546) + (28,4 mm Hg) (0, 454)
- Lpprisinājums = 51,92 mm Hg + 12,89 mm Hg = 64, 81 mm Hg
Padomi
- Lai izmantotu iepriekš minēto Clausius Clapeyron vienādojumu, temperatūra jāmēra Kelvinos (uzrakstīta kā K). Ja temperatūra ir pēc Celsija, tad tā jāpārvērš, izmantojot šādu formulu: Tk = 273 + T.c
- Iepriekš minētās metodes var izmantot, jo enerģija ir tieši proporcionāla pielietotajam siltuma daudzumam. Šķidruma temperatūra ir vienīgais vides faktors, kas ietekmē tvaika spiedienu.






